La leucemia linfoblástica aguda de células T (T-ALL) es un tumor hematológico agresivo, principalmente pediátrico, que se origina por alteraciones en los procesos moleculares de generación de los linfocitos T, en un órgano llamado timo. El tratamiento convencional es la quimioterapia intensiva, que conlleva efectos secundarios devastadores para los pacientes, principalmente para los niños. Además, existe una considerable frecuencia de pacientes no respondedores y una elevada tasa de recaídas con mal pronóstico. En consecuencia, es urgente desarrollar nuevas terapias, menos agresivas y más selectivas, dirigidas específicamente contra la leucemia y contra las células que la originaron, para eliminar las recaídas preservando a las células sanas del paciente y reduciendo así los efectos adversos
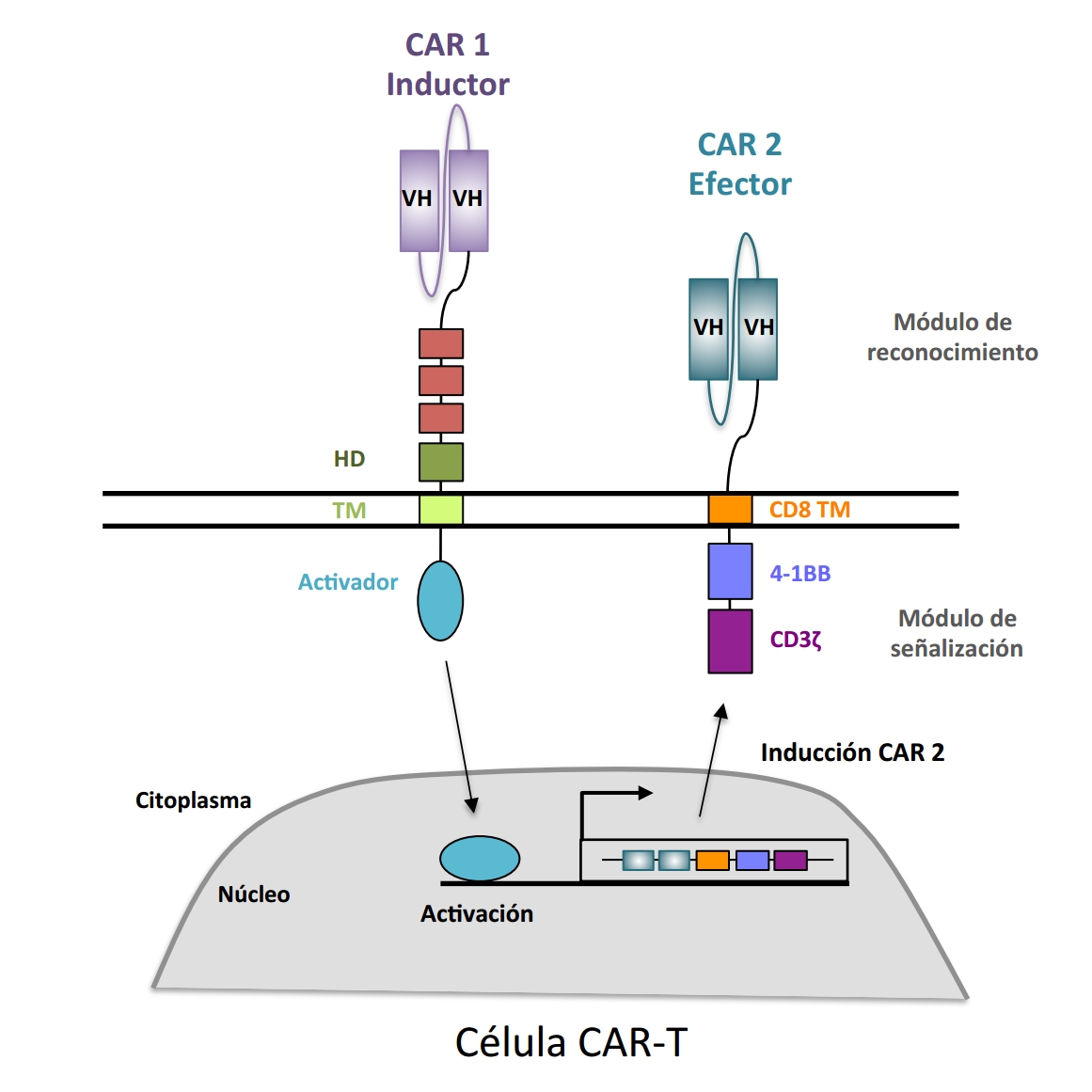
Con este objetivo, se han desarrollado recientemente diversas estrategias de inmunoterapia que aprovechan el poder del sistema inmunológico del paciente para destruir al tumor. Entre ellas, destaca la inmunoterapia con células T modificadas por ingeniería genética para expresar en su superficie un receptor híbrido o quimérico (CAR-T, del inglés Chimeric Antigen Receptor T cells). El CAR reconoce a la molécula del tumor mediante un módulo extracelular y activa a la célula CAR-T mediante un módulo de señalización (Figura1), induciendo la lisis y destrucción de la célula tumoral
Esta terapia ha mostrado un éxito sin precedentes en el tratamiento de tumores hematológicos refractarios, donde las células tumorales son linfocitos B. Sin embargo, hasta hoy, la inmunoterapia CAR-T no es una opción frente a las leucemias de células T, como la T-ALL. Esta limitación es debida a que las células T tumorales y las células T sanas expresan las mismas moléculas en la superficie que, además, son indistinguibles de las que expresan las propias CAR-T. En consecuencia, las CAR-T dirigidas a las T-ALL destruyen tanto a las células T tumorales como a las sanas, induciendo una inmunodeficiencia severa irreversible en los pacientes. Además, las CAR-T se destruyen entre sí, reduciéndose significativamente la eficiencia de la terapia.
Para trasladar la inmunoterapia CAR-T a la T-ALL y a otros tumores de células T, es esencial entender cuáles son las alteraciones moleculares que determinan la aparición de la enfermedad, y así poder identificar nuevas moléculas que se expresan en las células T que inician el tumor, responsables de las recaídas, pero que están ausentes en las células sanas. Este objetivo no es trivial, ya que no es posible estudiar retrospectivamente la aparición de las primeras células tumorales en el paciente. Para superar esta limitación, nuestro grupo desarrolló recientemente un nuevo modelo de generación de T-ALL humana en ratones, donde observamos una alteración en la generación de los linfocitos T acompañada de la aparición de una enfermedad que recapitula la T-ALL de los pacientes. Analizamos las alteraciones moleculares que aparecen secuencialmente durante la generación de la T-ALL, con el fin de identificar las células responsables del inicio de la leucemia y caracterizar nuevas moléculas implicadas en el proceso patogénico. Este estudio, resultado de un proyecto previo financiado por la AEI, permitió identificar una serie de alteraciones genéticas (mutaciones) y varias moléculas que se expresan de forma aberrante desde momentos iniciales de la generación de la T-ALL, lo que representa un significativo avance científico que proporciona la base para el diseño de nuevas estrategias terapéuticas.
Comprometidos con este objetivo, hemos iniciado un estudio financiado por este proyecto, para corroborar la implicación patogénica de algunas de las moléculas identificadas y caracterizar su función en la progresión de la T-ALL de los pacientes. La finalidad es diseñar una inmunoterapia con células CAR-T frente a ellas y obtener la confirmación de su eficacia, eliminando el tumor sin dañar a los linfocitos T sanos. Para emprender este desafío, generaremos células CAR-T que reconocerán sucesivamente dos moléculas tumorales. Estas CAR-T duales expresarán un receptor inductor (CAR-1) que reconocerá una molécula tumoral y activará la expresión del CAR efector convencional (CAR-2), específico de una segunda molécula tumoral. Así, la expresión del CAR-2 frente a la segunda molécula tumoral se inducirá exclusivamente tras el reconocimiento previo de la primera molécula, activando la función lítica de la célula CAR-T (Figura2).
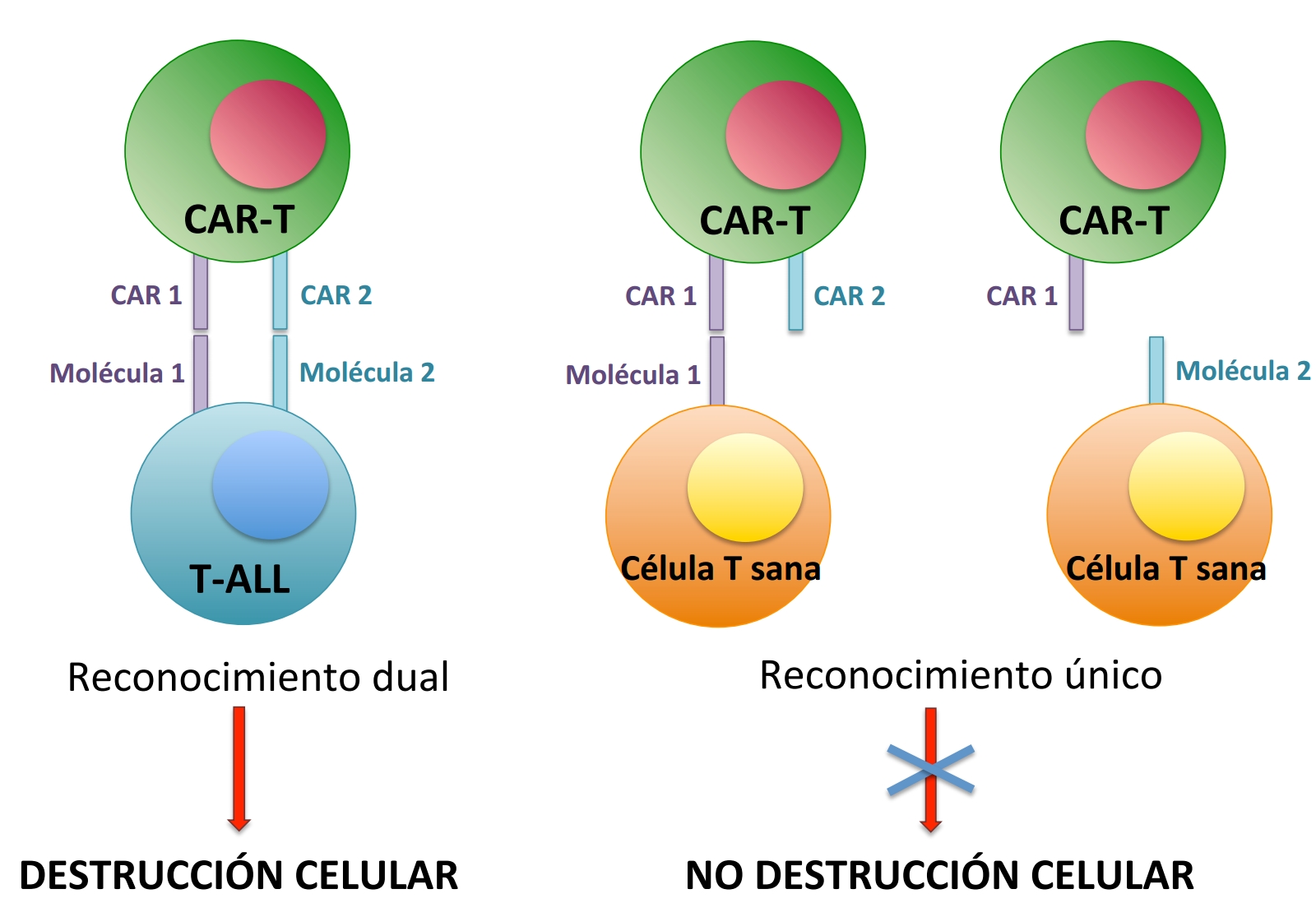
La finalidad es obtener evidencia directa en ensayos preclínicos de que un circuito de reconocimiento dual dota a las células T terapéuticas con un potencial de discriminación robusto, destruyendo a las células T tumorales con expresión simultánea de dos moléculas, pero dejando intactas a las células T sanas, incluso si portan una de las dos moléculas (Figura2), lo que evitará la inmunodeficiencia y la autodestrucción de CAR-T.
Prevemos que el éxito de esta estrategia tenga un importante impacto clínico, económico y social para el desarrollo de una nueva terapia eficiente frente a las diversas neoplasias de linfocitos T, para las que no existe alternativa a la quimioterapia. La disponibilidad de esta nueva inmunoterapia permitirá erradicar las recaídas y aumentar la esperanza de vida de los pacientes, reduciendo los efectos secundarios del tratamiento y mejorando su calidad de vida

Maria Luisa Toribio es doctora en biología por la Universidad Complutense de Madrid y Profesora de Investigación del Consejo Superior de Investigaciones Científicas (CSIC), en el Centro de Biología Molecular Severo Ochoa, centro mixto CSIC – Universidad Autónoma de Madrid. Realizó estancias postdoctorales en el Instituto Pasteur (París, Francia) y en el Instituto de Inmunología de Basilea (Suiza) y fue profesora visitante en el Center for Regenerative Medicine and Stem Cell Institute, Massachusetts General Hospital, Harvard Medical School (Boston, MA, EE.UU.). Su investigación se ha centrado en el estudio de los mecanismos responsables del desarrollo del sistema linfohematopoyético humano, contribuyendo a nuestro conocimiento actual del desarrollo fisiológico de los linfocitos T y las vías moleculares asociadas cuya desregulación conduce a la aparición de la T-ALL. Su grupo ha sido pionero en el desarrollo de modelos únicos de generación de T-ALL humana y de modelos preclínicos de inmunoterapia, proporcionando la prueba de concepto para nuevos desarrollos terapéuticos. Su investigación ha sido financiada por varias agencias nacionales e internacionales y varias fundaciones privadas, manteniendo una productiva actividad científica, con publicaciones relevantes en revistas internacionales de alto impacto, colaboraciones nacionales e internacionales y una extensa actividad formativa



